遺伝子発現を制御するシス−トランス因子間の分子共進化
これまでの進化学の考え方では、転写因子など遺伝子発現をトランスに制御する因子は保守的で、変化が遅いと信じられてきました。その理由は、例えば、転写因子が変化してしまうと、これが制御する多くの遺伝子の発現を一気に変えてしまい、生物に重篤な影響をおよぼすと予想されたからです。この予想と一致して、進化の過程では、各遺伝子の発現調節領域に起こるシス変異が重要であり、これにより個々の遺伝子レベルでの発現進化が起こったと報告されてきました。本研究では、これまで無視されてきたトランス因子とシス調節領域との補償的な変化も考慮して、進化のシミュレーションを行いました。その結果,これまでの研究ではシス変異が過大に評価されすぎていたことがわかりました。実際、約40万年前に分岐したショウジョウバエ近縁種を用いて実験を行ったところ、遺伝的背景を異種のものに置き換えた”アウェイ”の状況よりも、本来の”ホーム”の遺伝的背景でしばしば発現量が高くなる(図を参照)ことを見つけました.これは、これまで考えられているよりもずっと速い速度で、トランス因子と遺伝子本体(シス)とが協調しながら進化していることを示しています。つまり、トランス因子(細胞内環境)も変わるのです。
進化するトランス因子を同定することで細胞の発現環境をよりよく理解することに繋げます。
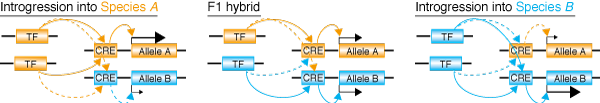
Two types of cis-trans compensation in the evolution of transcriptional regulation. Takahasi, K. R., Matsuo, T. and Takano-Shimizu-Kouno, T. (2011) Proceedings of the National Academy of Sciences USA 108, 15276-15281
発生過程の頑健性を支えるメカニズム
生命システムの特徴はその正確さと頑健さにあります。エラーを低く抑えるだけでなく、ノイズに対して頑健であることで正常な発生は保障されています。頑健性(ロバストネス)もまた、2つの要素で成立しています。ひとつは冗長性です。その最も単純な機構は遺伝子重複です。私達のゲノム中にもコピー数変異として知られる多型的な重複が数多く存在しています。私達はこの重複の生起率がゲノム比較から推定されるものより3桁高いこと(1)、さらに生じた重複の運命、殊に集団に固定、維持される条件を明らかにしました(2)。突然変異の多くが劣性であることの理由は自然淘汰によって冗長性が保たれていることにあるのかもしれません。
- Molecular spectrum of spontaneous de novo mutations in male and female germ line cells of Drosophila melanogaster. Watanabe, Y., Takahashi, A., Itoh, M. and Takano-Shimizu, T. (2009) Genetics 181, 1035-1043.
- Enhanced fixation and preservation of a newly arisen duplicate gene by masking deleterious loss-of-function mutations. Tanaka, K. M., Takahasi, K. R. and Takano-Shimizu, T. (2009) Genetics Research 91, 267-280.
2つ目の要素はノイズや撹乱によって生ずる歪みやエラーを能動的に修復する機構です。初期胚の発生はまず前後と背腹の軸をつくることから始まります。ショウジョウバエの前後軸は母親から与えられた bicoid が作る前高後低の濃度勾配によって形成が始まります。人工的に6個の bicoid 遺伝子をもった母親から生まれた胚は頭部が拡大し、尾部側が圧縮されたかたちになります。しかし、こうした撹乱にも関わらず成虫のアロメトリはほぼ正常です。これは拡大した頭部予定領域が過剰な細胞死で相殺,修復されているためです。しかし、どのような遺伝子が細胞死の引き金を引くのか、そもそもどうやって頭部が拡張したことを組織が、細胞がセンスするのかまったく分かっていません。私達はスクリーニングからこの組織の拡大によって起こる細胞死に関わる遺伝子を同定し、Mabiki と名付けました。この遺伝子はカスペース非依存的に、未分化の細胞に細胞死を誘導します。冗長な細胞死経路が頑健さの基盤を作っていると私達は考えています。
ゲノムに潜む、システムの頑健性を支えるメカニズムの全貌の解明に挑戦します。

器官のサイズコントロールとサイズの進化
体や器官のサイズは生存確率や競争の勝敗を決めてしまう要因で、遺伝的に制御されています。驚くことに器官は自律的に”正しい”サイズを知っているかのように振る舞いますが、その機構はよく分かっていません。器官サイズの制御と進化の機構の理解を深める上でショウジョウバエの複眼は優れたモデル系です。実際、ショウジョウバエの個眼数は近縁種のなかでも700から1000を超えるまで変異性に富んでいます。私達は成虫原基のなかで異なる組織への細胞の分配が種間のサイズ変異の主因となっていることを明らかにしました。これは翅で想定されるサイズの制御機構とは大きく異なります。サイズ制御の仕組みは区画化の時期に大きく依存することを示しています。
器官などの細胞集団のもつ自律的なサイズ制御の機構を明らかにしていきます。