生命活動は正確であるとともに頑健(ロバスト)でなければなりません。遺伝子の調子がちょっと悪かろうが、間違いが起ころうが、私たちは少々の逆境にもへこたれません。 私たちが運営する Kyoto Stock Center (DGRC) は現在、25,000を超えるショウジョウバエ系統を維持・管理しています。豊富な遺伝資源と恵まれた研究環境を生かし、日々研究に励んでいます。 具体的には現在、次の研究課題に取り組んでいます(研究内容のページへ)。 お問い合せは 高野 敏行 まで。 In our laboratory, we focus on ‘elucidating the mechanisms of neuronal robustness’ and ‘contributing to the study of neurological disorders.’ Our research explores how neurons withstand excessive activity and how this resilience changes in neurodegenerative conditions. As part of this research, we have developed a model of neuronal hyperactivity in the optic neurons of fruit flies induced by light stimulation, and have elucidated its pathological mechanisms. Furthermore, we have developed an automated quantification program using machine learning, ‘MeDUsA,’ advancing the identification and understanding of molecules related to the robustness of neurons.
Additionally, by utilizing fruit flies, we have clarified the pathological significance of genetic mutations, contributing to the research of rare diseases and autosomal dominant optic atrophy, among other neurological disorders. The use of fruit flies allows us to efficiently test the effects of many unexplored genetic mutations, even within time and budget constraints. The simplicity and rapid genetic analysis of fruit flies complement human disease research and have the potential to lead to the development of new treatments.
We aim to serve as a bridge between basic and clinical research, contributing to the understanding of neurological survival mechanisms, advancing our knowledge of neurological diseases, and aiding in diagnosis.
〒616-8354 メールでのお問い合わせはこちらWelcome to Takano-Shimizu, Tomaru & Sanuki Lab
Sorry! Some are Japanese only…
Takano-Shimizu, Toshiyuki
「歴史を再現し、今を知り、そして明日を視る」; 明日のための進化ゲノム学
一方で、生命は進化することを止めることもありません。環境に適応する進化能を併せもちます。遺伝学や発生生物学などのウエットな実験と集団遺伝学を基盤とする理論生物学とコンピューターシミュレーションを駆使したドライな解析の両面から、頑健性と適応という一見、相反する生命現象を支える遺伝子と細胞の働きを明らかにします。
頑健さは年齢と無縁ではありません。頑健さを通して老いること、死をみつめなおします。不老不死ではなく、生と死、老いについての理解を深めることで減薬社会をめざします。
Sugie, Atsushi
京都市右京区嵯峨一本木町1
京都工芸繊維大学 昆虫先端研究推進センター
ショウジョウバエ遺伝資源研究部門
Tel: 075-873-2660 (代表)
これまでの進化学の考え方では、転写因子など遺伝子発現をトランスに制御する因子は保守的で、変化が遅いと信じられてきました。その理由は、例えば、転写因子が変化してしまうと、これが制御する多くの遺伝子の発現を一気に変えてしまい、生物に重篤な影響をおよぼすと予想されたからです。この予想と一致して、進化の過程では、各遺伝子の発現調節領域に起こるシス変異が重要であり、これにより個々の遺伝子レベルでの発現進化が起こったと報告されてきました。本研究では、これまで無視されてきたトランス因子とシス調節領域との補償的な変化も考慮して、進化のシミュレーションを行いました。その結果,これまでの研究ではシス変異が過大に評価されすぎていたことがわかりました。実際、約40万年前に分岐したショウジョウバエ近縁種を用いて実験を行ったところ、遺伝的背景を異種のものに置き換えた”アウェイ”の状況よりも、本来の”ホーム”の遺伝的背景でしばしば発現量が高くなる(図を参照)ことを見つけました.これは、これまで考えられているよりもずっと速い速度で、トランス因子と遺伝子本体(シス)とが協調しながら進化していることを示しています。つまり、トランス因子(細胞内環境)も変わるのです。 進化するトランス因子を同定することで細胞の発現環境をよりよく理解することに繋げます。 Two types of cis-trans compensation in the evolution of transcriptional regulation. Takahasi, K. R., Matsuo, T. and Takano-Shimizu-Kouno, T. (2011) Proceedings of the National Academy of Sciences USA 108, 15276-15281 生命システムの特徴はその正確さと頑健さにあります。エラーを低く抑えるだけでなく、ノイズに対して頑健であることで正常な発生は保障されています。頑健性(ロバストネス)もまた、2つの要素で成立しています。ひとつは冗長性です。その最も単純な機構は遺伝子重複です。私達のゲノム中にもコピー数変異として知られる多型的な重複が数多く存在しています。私達はこの重複の生起率がゲノム比較から推定されるものより3桁高いこと(1)、さらに生じた重複の運命、殊に集団に固定、維持される条件を明らかにしました(2)。突然変異の多くが劣性であることの理由は自然淘汰によって冗長性が保たれていることにあるのかもしれません。 2つ目の要素はノイズや撹乱によって生ずる歪みやエラーを能動的に修復する機構です。初期胚の発生はまず前後と背腹の軸をつくることから始まります。ショウジョウバエの前後軸は母親から与えられた bicoid が作る前高後低の濃度勾配によって形成が始まります。人工的に6個の bicoid 遺伝子をもった母親から生まれた胚は頭部が拡大し、尾部側が圧縮されたかたちになります。しかし、こうした撹乱にも関わらず成虫のアロメトリはほぼ正常です。これは拡大した頭部予定領域が過剰な細胞死で相殺,修復されているためです。しかし、どのような遺伝子が細胞死の引き金を引くのか、そもそもどうやって頭部が拡張したことを組織が、細胞がセンスするのかまったく分かっていません。私達はスクリーニングからこの組織の拡大によって起こる細胞死に関わる遺伝子を同定し、Mabiki と名付けました。この遺伝子はカスペース非依存的に、未分化の細胞に細胞死を誘導します。冗長な細胞死経路が頑健さの基盤を作っていると私達は考えています。 ゲノムに潜む、システムの頑健性を支えるメカニズムの全貌の解明に挑戦します。 体や器官のサイズは生存確率や競争の勝敗を決めてしまう要因で、遺伝的に制御されています。驚くことに器官は自律的に”正しい”サイズを知っているかのように振る舞いますが、その機構はよく分かっていません。器官サイズの制御と進化の機構の理解を深める上でショウジョウバエの複眼は優れたモデル系です。実際、ショウジョウバエの個眼数は近縁種のなかでも700から1000を超えるまで変異性に富んでいます。私達は成虫原基のなかで異なる組織への細胞の分配が種間のサイズ変異の主因となっていることを明らかにしました。これは翅で想定されるサイズの制御機構とは大きく異なります。サイズ制御の仕組みは区画化の時期に大きく依存することを示しています。 器官などの細胞集団のもつ自律的なサイズ制御の機構を明らかにしていきます。 Neurons exhibit resilience to stress, both internally and externally, maintaining robustness even under the stress caused by excessive activity, commonly referred to as neuronal hyperactivity. However, this resilience to hyperactivity is not lifelong; it diminishes with age and is further compromised by neurodegenerative diseases like Alzheimer’s and Parkinson’s. A key question arises: what molecular events become critical under the stress of hyperactivity? To investigate this, we have been utilizing fruit flies’ optic neurons, functioning as photoreceptors, as a model system. Our research has replicated neuronal hyperactivity through short-term light stimulation, leading to reversible synaptic reorganization. This process has helped clarify its molecular mechanism (Neuron 86(3):711-25, 2015). We found that prolonged light stimulation leads to neurodegeneration. Consequently, we established an experimental system that enables quantitative monitoring of synaptic loss and axonal degeneration (J. Neurosci. 42(24):4937-4952, 2022). While this system is based on an artificially induced ‘light stress’ scenario, it effectively simulates the synaptic loss and axonal changes associated with neuronal hyperactivity, offering valuable insights into the pathology of various neurodegenerative diseases. Moreover, we developed an automated machine learning analysis program, MeDUsA (Hum. Mol. Genet. 32(9):1524-1538, 2023), which has been successful in quantifying neurodegeneration in a large number of samples. This degeneration is caused by the proteins such as Tau, aSyn, TDP-43, and Htt polyQ. Leveraging these findings, and using advanced synaptic analysis techniques alongside our neurodegeneration quantification system, we are dedicated to exploring the molecules essential for neuronal survival and elucidating their underlying mechanisms. We have gained opportunities for collaborative research with clinical research institutions and have recognized that data rapidly obtained from experiments using fruit flies can effectively complement human genome analysis, in silico analysis, mouse and human cultured cells, and clinical studies. So far, we have achieved significant findings in neurological disease research, including the discovery of gene mutations causing central nervous system disorders in rare diseases (Sci. Rep. 13(1):975, 2023; Eur. J. Med. Genet. 66(8):104804. 2023; AJHG 110(8):1356-1376. 2023; Hum. Mol. Genet. 31(1):69-81. 2021) and the development of models to examine the pathological significance of mutations in OPA1, a gene responsible for Autosomal Dominant Optic Atrophy (ADOA) (eLife 23:12:RP87880. 2024). Consequently, we have confirmed the effectiveness of research using the simple model organism, the fruit fly, in clinical studies. With this in mind, we are dedicated to contributing to the field of disease research. The Initiative on Rare and Undiagnosed Diseases (IRUD), driven by AMED (Japan Agency for Medical Research and Development), leverages genomic medicine to diagnose patients with rare and previously undiagnosed diseases. This approach has been made possible by recent rapid advancements in genetic analysis technology, yet it introduces new challenges. A primary challenge is the rise in Variants of Uncertain Significance (VUS) – genetic mutations with unclear roles in disease processes. Clarifying the pathological significance of these VUS requires validation of their effects both in vitro and in vivo. However, such analyses, especially in mouse models, are often not time and cost-effective without definitive evidence of their impact. To overcome this bottleneck, we utilize fruit flies for their rapid and cost-effective genetic analysis capabilities, enabling us to efficiently identify the pathological effects of disease-causing gene mutations. In partnership with clinical researchers, we are committed to elucidating as many VUS as possible. While merely identifying the pathological relevance does not equate to curing the disease, understanding the underlying causes can significantly aid in formulating treatment strategies, thereby offering reassurance to patients who have previously faced uncertainty. We are deeply motivated to contribute to this area, as echoed by the insights we have gained from numerous medical professionals.Sorry! Some are Japanese only…
遺伝子発現を制御するシス−トランス因子間の分子共進化
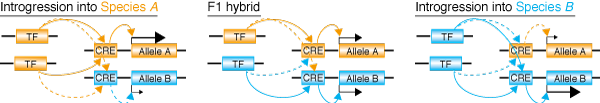
発生過程の頑健性を支えるメカニズム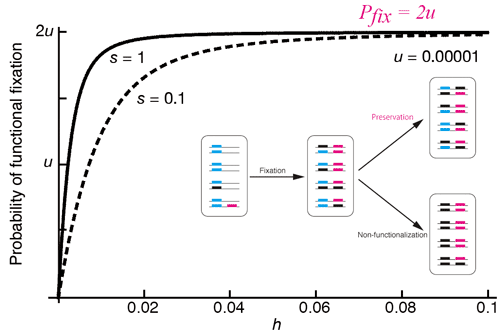

器官のサイズコントロールとサイズの進化
Mechanisms Sustaining Neuronal Robustness
Disease Research Using the Simple Model Organism, the Fruit Fly
Clarifying Genomic Variants of Uncertain Significance and Supporting Personalized Medicine
生殖学:雑種不妊にみられる脆弱な精巣形成の理由
配偶行動・雌雄のコミュニケーション
遺伝子ネットワーク構築法の開発
Takano-Shimizu-kouno, Toshiyuki 19年在職した国立遺伝学研究所をはなれ、2012年4月に嵯峨にやってきました。本人としてはかなり思いきった決断。 「歴史を再現し、今を知り、そして明日を視る」明日のための進化ゲノム学を遂行中。理論と実験に想像力で、目には直接みえない生命の動き、働きや進化を明らかにする。 科学の世界に肩書き不要。相手への礼節は必要。ジャーナル・クラブは自分の売りと売りかたを身につける修練道場。 Tomaru, Masatosh ⇒ Tomaru’s page Sato Katsunori Inai Kotori 2021 < Completed Master’s Program > 2020 < Completed Master’s Program > 2019 < Completed Master’s Program > 2018 < Completed Master’s Program > 2017 < Undergraduate Program Graduation > 2016 < Completed Master’s Program > 2015 < Undergraduate Program Graduation > Timothy L. Karr Arizona State University Sorry! Most parts are in Japanese…
Professor

Professor
Assistant Professor
Master’s Program of Applied Biology
Suzuki Fumiko
Yamaoka MasakiUndergraduate Program of Applied Biology
Iwasaki shiho
Kikugawa Tori
Sakurai Moe
Former members of Takano-Shimizu , Tomaru & Sanuki Laboratories including National Institute of Genetics
Monden Masaki
Oiwa Kazuharu
Tanaka Tomoya
< Undergraduate Program Graduation >
Matsumoto Kanki, Yamamura Tomonori
Ibaraki Kimihide
Kawashima Shota, Shirakami Machi
< Undergraduate Program Graduation >
Kawachi Shugetsu, Kimura Yuki
Wakada Haruka
Matsuda Takeru, Miyazaki Yu, Nakatsuka Mihoko, Sasazaki Daisuke
< Undergraduate Program Graduation >
Tamura Ryoma, Yamamoto Syunsuke
Murakami Ginga, Tachibana Eiichi
森田 俊平 東北大学浅虫海洋生物学教育研究センター 助教
田中 健太郎 東京都立大学理学研究科特任研究員(2015年4月より)
高橋 文 東京都立大学理学研究科 准教授(2012年4月1日より)
高橋 亮 福岡女子大学国際文理学部 学術研究員
河邊 昭 京都産業大学生命科学部先端生命科学科 教授
藤川 和世 (株)エヌビィー健康研究所(2009年11月1日より)
高橋 一男 神奈川大学理学部生物科学科 教授
渡邊 豊 イルミナ株式会社
立田 晴記 九州大学理学研究室生物科学部門 教授(2021年6月より)
2024 Nitta Y., Osaka J., Maki R., Hakeda-Suzuki S., Suzuki E., Ueki S., Suzuki T., Sugie A., (2024) eLife 10.7554/eLife.87880.2 model to clarify the pathological significance of OPA1 in autosomal dominant optic atrophy. Chauvin SD, Ando S, Holley JA, Sugie A., Zhao FR, Poddar S, Kato R, Miner CA, Nitta Y, Krishnamurthy SR, Saito R, Ning Y, Hatano Y, Kitahara S, Koide S, Stinson WA, Fu J, Surve N, Kumble L, Qian W, Polishchuk O, Andhey PS, Chiang C, Liu G, Colombeau L, Rodriguez R, Manel N, Kakita A, Artyomov MN, Schultz DC, Coates PT, Roberson EDO, Belkaid Y, Greenberg RA, Cherry S, Gack MU, Hardy T, Onodera O, Kato T,corresponding author and Miner JJ,corresponding author. (2024) Nat Commun. 15: 4696. Inherited C-terminal TREX1 variants disrupt homology-directed repair to cause senescence and DNA damage phenotypes in Drosophila, mice, and humans. Iida T., Igarashi A., Fukunaga K., Aoki T., Hidai T., Yanagi K., Yamamori M., Satou K., Go H., Kosho T., Maki R., Suzuki T., Nitta Y., Sugie A., Asaoka Y., Furutani-Seiki M., Kimura T., Matsubara Y., Kaname T. (2024) Front. Genet. 15:1383176. doi: 10.3389/fgene.2024.1383176 Functional analysis of RRAS2 pathogenic variants with a Noonan-like phenotype. Osaka J, Ishii A, Wang X, Iwanaga R, Kawamura H, Akino S, Sugie A, Hakeda-Suzuki S, Suzuki T. (2024) Cell Rep. Feb 19;43(2):113798. doi: 10.1016/j.celrep.2024.113798. Online ahead of print. PMID: 38381608 Complex formation of immunoglobulin superfamily molecules Side-IV and Beat-IIb regulates synaptic specificity. 2023 Vetro et al., (2023) The American Journal of Human Genetics 110(8):1356-1376. doi: 10.1016/j.ajhg.2023.06.008 Stretch-activated ion channel TMEM63B associates with developmental and epileptic encephalopathies and progressive neurodegeneration. Yamada M., Nitta Y. Uehara T., Suzuki H., Takenouchi T., Tamura M., Ayabe S., Yoshiki A., Maeno A., Saga Y., Tamio Furuse T., Yamada I., Okamoto N., Sugie A.†, Kosaki K.†, (2023) European Journal of Medical Genetics 66(8):104804. doi: 10.1016/j.ejmg.2023.104804 Heterozygous loss-of-function DHX9 variants are associated with neurodevelopmental disorders.† Co-corresponding authors Nitta Y., Osaka J., Maki R., Hakeda-Suzuki S., Suzuki E., Ueki S., Suzuki T., Sugie A., (2023) eLife Drosophila model to clarify the pathological significance of OPA1 in autosomal dominant optic atrophy. reviewed preprint Itai T., Sugie A., Nitta Y., Maki R., Suzuki T., Shinkai Y., Watanabe Y., Nakano Y., Ichikawa K., Okamoto N., Utsuno Y., Koshimizu E., Fujita A., Hamanaka K., Uchiyama Y., Tsuchida N., Miyake N., Misawa K., Mizuguchi T., Miyatake S., Matsumoto N. (2023) Scientific Reports, Volume 13, Article number: 975. A novel NONO variant that causes developmental delay and cardiac phenotypes. Nitta Y., Kawai H., Maki R., Osaka J., Hakeda-Suzuki S., Nagai Y., Doubková K., Uehara T., Watanabe K., Kosaki K., Suzuki T., Tavosanis G., Sugie A. (2023) Human Molecular Genetics, Volume 32, Issue 9, Pages 1524-1528. Direct evaluation of neuroaxonal degeneration with the causative genes of neurodegenerative diseases in Drosophila using the automated axon quantification system, MeDUsA. SugieLab/MeDUsA (github.com) 2022 Osaka J., Yasuda H., Watanuki Y., Kato Y., Nitta Y., Sugie A., Sato M., Suzuki T. (2022) Genes & Genetic Systems, Volume 97, Issue 6, Pages 297-309. Identification of genes regulating stimulus-dependent synaptic assembly in Drosophila using an automated synapse quantification system. Nitta Y., Sugie A.. (2022) Fly, Volume 16, Issue 1, Pages 275-298. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Richard M., Doubková K., Nitta Y., Kawai H., Sugie A.†, Tavosanis G.† (2022) The Journal of Neuroscience, Volume 42, Issue 24, Pages 4937-4952. A Quantitative Model of Sporadic Axonal Degeneration in the Drosophila Visual System.† Co-corresponding authors Utomo Y. R., Sugie A.†, Okada S., Miura K., Nakamura H.† (2022) Chemical Communications, Volume 58, Issue 15, Pages 2576-2579. Detoxification of amyloid β fibrils by curcumin derivatives and their verification in a Drosophila Alzheimer’s model. † Co-corresponding authors 2021 Kato T., Manabe R., Igarashi H., Kametani F., Hirokawa S., Sekine Y., Fujita N., Saito S., Kawashima Y., Hatano Y., Ando S., Nozaki H., Sugai A., Uemura M., Fukunaga M., Sato T., Koyama A., Saito R., Sugie A., Toyoshima Y., Kawata H., Murayama S., Matsumoto M., Kakita A., Hasegawa M., Ihara M., Kanazawa M., Nishizawa M., Tsuji S., Onodera O. (2021) Journal of Clinical Investigation, Volume 131, Issue 22, e140555. Candesartan prevents arteriopathy progression in cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy model. Sakamoto M., Sasaki K., Sugie A., Nitta Y., Kimura T., Gürsoy S., Cinleti T., Iai M., Sengoku T., Ogata K., Suzuki A, Okamoto N., Iwama K., Tsuchida N., Uchiyama Y., Koshimizu E., Fujita A., Hamanaka K., Miyatake S., Mizuguchi T., Taguri M., Ito S., Takahashi H., Miyake N., Matsumoto N. (2021) Human Molecular Genetics, Volume 31, Issue 1, Pages 69-81. De novo ARF3 variants cause neurodevelopmental disorder with brain abnormality Takechi H., Hakeda-Suzuki S., Nitta Y., Ishiwata Y., Iwanaga R., Sato M., Sugie A., Suzuki T. (2021) eLife, Volume 10, e66718. Glial insulin regulates cooperative or antagonistic Golden goal/Flamingo interactions during photoreceptor axon guidance. 2019 Nitta Y., Matsui S., Kato Y., Kaga Y., Sugimoto K., Sugie A. (2019) Scientific Reports, Volume 9, Article number: 8857. Analysing the evolutional and functional differentiation of four types of Daphnia magna cryptochrome in Drosophila circadian clock. 2018 Sugie A., Marchetti G., Tavosanis G. (2018) Neural Development, Volume 13, Article number: 14. Structural aspects of plasticity in the nervous system of Drosophila. Itoh, M., Kajihara, R., Kato, Y., Takano-Shimizu, T., and Inoue, Y. (2018) Frequencies of chromosomal inversions in Drosophila melanogaster in Fukushima after the nuclear power plant accident. PLoS ONE 13(2): e0192096 植田充美 監修/高野敏行他36名 バイオテクノロジーシリーズ – AI導入によるバイオテクノロジーの発展 Development of Biotechnology by the Introduction of AI シーエムシー出版 2018年2月9日発行 Tomaru, M., Ohsako, T., Watanabe, M., Juni, N., Matsubayashi, H., Sato, H., Takahashi, A., & Yamamoto, M.-T. 2018. Severe fertility effects of sheepish sperm caused by failure to enter female sperm storage organs in Drosophila melanogaster. G3 (Bethesda) 8: 149–160 https://doi.org/10.1534/g3.117.300171 2017 Sugie A.†, Möhl C.†, Hakeda-Suzuki S., Matsui H., Suzuki T., Tavosanis G. (2017) Journal of Visualized Experiments, 120, e55716. Analyzing synaptic modulation of Drosophila photoreceptors after exposure to prolonged light. † Co-corresponding authors Nitta Y.† and Sugie A.† (2017) Biochemical and Biophysical Research Communications, Volume 487, Issue 1, Pages 116-121. DISCO Interacting Protein 2 determines direction of axon projection under the regulation of c-Jun N-terminal kinase in the Drosophila mushroom body. † Co-corresponding authors Nitta Y.† and Sugie A.† (2017) Biochemical and Biophysical Research Communications, Volume 487, Issue 4, Pages 898-902. Identification of glaikit in a genome-wide expression profiling for axonal bifurcation of the mushroom body in Drosophila. † Co-corresponding authors Nitta Y., Yamazaki D., Sugie A., Hiroi M., Tabata T. (2017) Developmental Biology, Volume 421, Issue 2, Pages 233-244. DISCO Interacting Protein 2 regulates axonal bifurcation and guidance of Drosophila mushroom body neurons. Matsumoto, Y., Goto, T., Nishino, J., Nakaoka, H., Tanave, A., Takano-Shimizu, T., Mott, R. F., and Koide, T. (2017) Selective breeding and selection mapping using a novel wild-derived heterogeneous stock of mice revealed two closely-linked loci for tameness. Scientific Reports 7, 4607 鷲谷いづみ 監修/桂勲 編 高野敏行他7名 遺伝学 –遺伝子から見た生物– 培風館 2017年1月20日発行 2015
Sugie A., Hakeda-Suzuki S., Suzuki E., Silies M., Shimozono M., Möhl C., Suzuki T. and Tavosanis G. (2015) Neuron, Volume 86, Issue 3, Pages 711-725. Molecular remodeling of the presynaptic active zone of Drosophila photoreceptors via activity-dependent feedback. 2014 Kanamori, T., Yasuno, Y., Tomaru, T., and Takano-Shimizu-Kouno, T. Reduced male fertility of the Canton-S strain due to spermiogenic failure. (2014) Drosophila Information Service 97, 21-24 遺伝子が語る生命38億年の謎 - なぜ、ゾウはネズミより長生きか?、2014年6月、悠書館(国立遺伝学研究所 編 第1章を執筆) Tanaka,K.M.*,Takahashi,A.,Fuse,N.,and Takano-Shimizu-Kouno,T.* (2014)A novel cell death gene acts to repair patterning defects in Drosohila melanogaster.Genetics 197,739-742. doi:10.1534/genetics.114.163337.Text Shirata, M., Araye, Q., Maehara, K., Enya, S., Takano-Shimizu, T., and Sawamura, K. (2014) Allelic asymmetry of the Lethal hybrid rescue (Lhr) gene expression in the hybrid between Drosophila melanogaster and D. simulans: confirmation by using genetic variations of D. melanogaster. Genetica 142, 43-48.Text 2013 Berger-Müller S.†, Sugie A.†, Takahashi F., Tavosanis G., Hakeda-Suzuki S., Suzuki T. (2013) PLOS ONE, Volume 8, Issue 12, e83732. Assessing the role of cell-surface molecules in central synaptogenesis in the Drosophila visual system. 遺伝子図鑑、2013年10月、悠書館(国立遺伝学研究所「遺伝子図鑑」編集委員会、斉藤成也、荒木弘之、角谷徹仁、小林武彦、高野敏行 編集) 岩波 生物学辞典 第5版、2013年2月、岩波書店(新項目「量的形質遺伝子座」の執筆と50項目の校閲を担当) 2012 Koide, T., Goto, T., and Takano-Shimizu T. (2012) Genomic Mixing to Elucidate the Genetic System of Complex Traits. Experimental Animals 61, 503-509. Nishimura, A., Ishida, Y., Takahashi, A., Okamoto, H., Sakabe, M., Itoh, M., Takano-Shimizu, T., and Ozaki M. (2012) Starvation-induced elevation of taste responsiveness and expression of a sugar taste receptor gene in Drosophila melanogaster. Journal of Neurogenetics 26, 206-215. 進化学事典、2012年4月、日本進化学会編、共立出版(16.1「遺伝子とは」と20.21「形質の遺伝的変異」を担当) Takahashi, A., Fujiwara-Tsujii, N., Yamaoka, R., Itoh, M., Ozaki, M. and Takano-Shimizu, T. (2012) Cuticular hydrocarbon content that affects male mate preference of Drosophila melanogaster from West Africa. Int. J. Evol. Biol. Volume 2012, Article ID 278903. 2011 Takahashi, A. and Takano-Shimizu, T. (2011) Divergent enhancer haplotype of ebony on inversion In(3R)Payne associated with pigmentation variation in a tropical population of Drosophila melanogaster. Molecular Ecol. 20, 4277-87. Takahasi, K. R., Matsuo, T. and Takano-Shimizu-Kouno, T. (2011) Two types of cis-trans compensation in the evolution of transcriptional regulation. Proc. Natl. Acad. Sci. USA 108, 15276-15281 Takahashi, K. H., Daborn, P. J., Hoffmann, A. A., and Takano-Shimizu, T. (2011) Environmental stress-dependent effects of deletions encompassing Hsp70Ba on canalization and quantitative trait asymmetry in Drosophila melanogaster. PLoS ONE 6, e17295 2010 Sugie A., Umetsu D., Yasugi T., Fischbach K-F., Tabata T. (2010) Development, Volume 137, Issue 19, Pages 3303-3313. Recognition of pre- and postsynaptic neurons via nephrin/NEPH1 homologs is a basis for the formation of the Drosophila retinotopic map. Yasugi T., Sugie A., Umetsu D., Tabata T. (2010) Development, Volume 137, Issue 19, Pages 3193-3203. Coordinated sequential action of EGFR and Notch signaling pathways regulates proneural wave progression in the Drosophila optic lobe. Taniue K., Nishida A., Hamada F., Sugie A., Oda T., Ui-Tei K., Tabata T., Akiyama T. (2010) Development, Volume 137, Issue 10, Pages 1755-1764. Sunspot, a link between Wingless signaling and endoreplication in Drosophila. Itoh, M., Nanba, N., Hasegawa, M., Inomata, N., Kondo, R., Oshima, M. and Takano-Shimizu, T. (2010) Seasonal changes in the long-distance linkage disequilibrium in Drosophila melanogaster. J. Hered. 101, 26-32. Sawamura, K., Maehara, K., Mashino, S., Kagesawa, T., Kajiwara, M., Matsuno, K., Takahashi, A., and Takano-Shimizu, T. (2010) Introgression of Drosophila simulans nuclear pore protein 160 in Drosophila melanogaster alone does not cause inviability but does cause female sterility Genetics 186, 669-676 Takahashi, K. H., Rako, L., Takano-Shimizu, T., Hoffmann, A.A., and Lee, S.F. (2010) Effects of small Hsp genes on developmental stability and microenvironmental canalization. BMC Evol. Biol. 10, 284 2009 Tatsuta, H. and Takano-Shimizu, T. (2009) High genetic differentiation between an African and a non-African strain of Drosophila simulans revealed by segregation distoration and reduced crossover frequency. Genetica 137, 165-171. Fujikawa, K., Takahashi, A., Nishimura, A., Itoh, M., Takano-Shimizu, T. and Ozaki, M. (2009) Characteristics of genes up-regulated and down-regulated after 24 h starvation in the head of Drosophila. Gene 446, 11-17 Tanaka, K. M., Takahasi, K. R. and Takano-Shimizu, T. (2009) Enhanced fixation and preservation of a newly arisen duplicate gene by masking deleterious loss-of-function mutations. Genetics Research 91, 267-280. Watanabe, Y., Takahashi, A., Itoh, M. and Takano-Shimizu, T. (2009) Molecular spectrum of spontaneous de novo mutations in male and female germline cells of Drosophila melanogaster. Genetics 181, 1035-1043. Takahashi, K. H., Tanaka, K., Itoh, M. and Takano-Shimizu, T. (2009) Reduced X-linked rare polymorphism in males in comparison to females of Drosophila melanogaster. J. Heredity 100, 97-105. 進化 — 分子・個体・生態系、宮田隆、星山大介 監訳、メディカル・サイエンス・インターナショナル(第14章) p.413-445 (ISBN 4895926214) (“Evolution” (Barton, N. H., Briggs, D. E. G., Eisen, J. A., Goldstein, D. B., and Patel, N. H., 2007, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York), の第14章, “Variation in Genetically Complex Traits”, p. 381-412の日本語訳) 2008 Mizuno N., Sugie A., Kobayashi F., Takumi S. (2008) Journal of Plant Physiology, Urban & Fischer, Volume 165, Issue 4, Pages 462-467. Mitochondrial alternative pathway is associated with development of freezing tolerance in common wheat. Inomata, N., Itoh, M., Kondo, R., Ohshima, M., Inoue, Y., and Takano-Shimizu, T. (2008). A new test for detecting ongoing selection. Genetica 133, 321-334 2007 Sugie A., Murai K., Takumi S. (2007) Genes and Genetic Systems, Genetics Society Of Japan, Volume 82, Issue 3, Pages 231-239. Alteration of respiration capacity and transcript accumulation level of alternative oxidase genes in necrosis lines of common wheat. Takahashi, A., Takahashi, K., Ueda, R., and Takano-Shimizu, T. (2007). Natural variation of ebony gene controlling thoracic pigmentation in Drosophila melanogaster. Genetics 177, 1233-1237. Noro,Y., Takano-Shimizu,T., Syono, K., Kishima,Y., and Sano, Y. (2007). Genetic variations in rice in vitro cultures at the EPSPs-RPS20 region. Theor. Appl. Genet. 114, 705-711. Text 2006 Sugie A., Naydenov N., Mizuno N., Nakamura C., Takumi S. (2006) Genes and Genetic Systems, Genetics Society Of Japan, Volume 81, Issue 5, Pages 349-354. Overexpression of wheat alternative oxidase gene Waox1a alters respiration capacity and response to reactive oxygen species under low temperature in transgenic Arabidopsis. Tatsuta, H., and Takano-Shimizu, T. (2006). Genetic architecture of variation in sex-comb tooth number in Drosophila simulans. Genet. Res. 87, 93-107. Takeuchi, T., Watanabe, Y., Takano-Shimizu , T., Kondo, S. (2006). Roles of jumonji and jumonji family genes in chromatin regulation and development. Dev. Dyn. 235, 2449-2459. 2005 Kobayashi, S., Noro, Y., Nagano, H., Yoshida, K., Takano-Shimizu, T., Kishima, Y., and Sano, Y. (2005). Evidence for an evolutionary force that prevents epigenetic silencing between tail-to-tail rice genes with a short spacer. Gene 346, 231-240. Takahashi, A., and Takano-Shimizu, T. (2005). A high frequency null mutant of an odorant-binding protein gene, Obp57e, in Drosophila melanogaster. Genetics 170, 709-18. 遺伝学事典、2005年、東江昭夫、徳永勝士、町田泰則 編、朝倉書店(ISBN 4254171242) (対立遺伝子、優性、不完全優性、表現型、交雑、雑種、雑種強勢、他家受精、両性雑種、モルガン単位、異型接合の11項目について執筆) 2004 Takano-Shimizu, T., Inomata, N., Nanba, N., Kondo, R., Inoue, Y., and Itoh, M. (2004). Inter-locus nonrandom association of polymorphisms in Drosophila chemoreceptor genes. Proc. Natl. Acad. Sci. USA 101, 14156-14161. Oka, A., Mita, A., Sakurai-Yamatani, N., Yamamoto, H., Takagi, N., Takano-Shimizu, T., Toshimori, K., Moriwaki, K., and Shiroishi, T. (2004). Hybrid breakdown caused by substitution of the X chromosome between two mouse subspecies. Genetics 166, 913-924. Text 2002 Sakai, T., Isono, K., Tomaru, M., Fukatami, A., and Oguma, Y. (2002). Light wavelength dependency of mating activity in the Drosophila melanogaster species subgroup. Genes Genet. Sys. 77, 187 – 195. Yamada, H., Sakai, T., Tomaru, M., Doi, M., Matsuda, M., and Oguma, Y. (2002). Search for species-specific mating signal in courtship songs of sympatric sibling species, Drosophila ananassae and D. pallidosa. Genes Genet. Sys. 77, 97 – 106. Furuse, T., Takano-Shimizu, T., Moriwaki, K., Shiroishi, T., and Koide, T. (2002). QTL analyses of spontaneous activity by using mouse strains from Mishima battery. Mamm. Genome 13, 411-415. 2001 Takano-Shimizu, T. (2001). Local changes in GC/AT substitution biases and in crossover frequencies on Drosophila chromosomes. Mol. Biol. Evol.18, 606-619. Doi, M., Matsuda, M., Tomaru, M., Matsubayashi, H., and Oguma, Y. (2001). A locus for female discrimination behavior causing sexual isolation in Drosophila. Proc. Natl. Acad. Sci. USA 98, 6714 – 6719. 2000 Takano-Shimizu, T. (2000). Genetic screens for factors involved in the notum bristle loss of interspecific hybrids between Drosophila melanogaster and D. simulans. Genetics 156, 269-282 Tomaru, M., and Oguma, Y. (2000) Mate choice in Drosophila melanogaster and D. sechellia: criteria and their variation depending on courtship song. Anim. Behav. 60, 797 – 804 Tomaru, M., Doi, M, Higuchi, H., and Oguma, Y. (2000) Courtship song recognition in the Drosophila melanogaster complex: Heterospecific songs makes females receptive in D. melanogaster but not in D. sechellia. Evolution 54, 1286 – 1294 . 1999 Takano-Shimizu, T. (1999). Local recombination and mutation effects on molecular evolution in Drosophila. Genetics 153, 1285-1296. Yamashita, S., Takano-Shimizu, T., Kitamura, K., Mikami, T., and Kishima, Y. (1999). Resistance to gap repair of the transposon Tam3 in Antirrhinum majus: A role of the end regions. Genetics 153, 1899-1908. Text . 1998 Takano, T. S. (1998). Loss of notum macrochaetae as an inter-specific hybrid anomaly between Drosophila melanogaster and D. simulans. Genetics 149, 1435-1450. Takano, T. S. (1998). Rate variation of DNA sequence evolution in the Drosophila lineages. Genetics 149, 959-970. Tomaru, M., Matsubayashi, H., and Oguma, Y. (1998) Effects of courtship song in inter-specific crosses among the species of the Drosophila auraria complex (Diptera: Drosophilidae). J. Insect Behav. 11, 383 – 398.
†These authors contributed equally.
